
问题详情
[单选]下列有关溶液叙述正确的是()。
A.溶液一旦达到过饱和就能自发的析出晶体
B.过饱和溶液的温度与饱和溶液的温度差成为过饱和度
C.过饱和溶液可以通过冷却饱和溶液来制备
D.对一定的溶质和溶剂其超饱和解度曲线只有一条
相关热点: 过饱和溶液 温度差
未搜索到的试题可在搜索页快速提交,您可在会员中心"提交的题"快速查看答案。
收藏该题
查看答案

搜题

相关问题推荐
[单选]结晶进行的先决条件是()。
A.过饱和溶液
B.饱和溶液
C.不饱和溶液
D.都可以
A.过饱和溶液
B.饱和溶液
C.不饱和溶液
D.都可以
关于溶质的过饱和度,下列说法正确的是()。
A、是指溶质过饱和溶液的浓度
B、是指溶质过饱和溶液的浓度与饱和溶液的浓度之比
C、过饱和溶液可维持在一定的过饱和度范围内无晶体析出
D、当过饱和度超过某一特定值时,过饱和溶液中就会自发形成大量晶核
下列对溶解或结晶叙述正确的是()
A、溶液一旦达到饱和,就能自发地析出晶体
B、过饱和溶液的温度与饱和溶液的温度差称为过饱和度
C、过饱和溶液可通过冷却饱和溶液来制备
D、对一定的溶液和溶剂,其超溶解度曲线只有一条
[单选]造成后沉淀的原因,说法错误的是()。
A.由于沉淀表面吸附了构晶离子
B.由于沉淀表面吸附的构晶离子再吸附溶液中带相反电荷的杂质离子
C.由于沉淀陈化的时间不够长
D.由于在沉淀表面附近形成了过饱和溶液
A.由于沉淀表面吸附了构晶离子
B.由于沉淀表面吸附的构晶离子再吸附溶液中带相反电荷的杂质离子
C.由于沉淀陈化的时间不够长
D.由于在沉淀表面附近形成了过饱和溶液
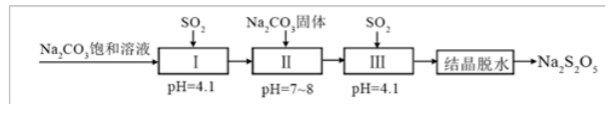
焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:①pH=4.1时,Ⅰ中为__________溶液(写化学式)。②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
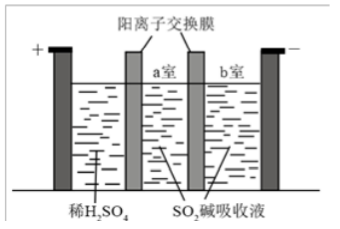
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00mL葡萄酒样品,用0.01000mol·L-1的碘标准液滴定至终点,消耗10.00mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L-1(以SO2计)。
